El presente trabajo brinda la información con la que se cuenta en la actualidad en relación con el diagnóstico, la epidemiología, la etiología y el manejo clínico de la hipersensibilidad dentinaria. Resume los enfoques técnicos que se aplican para aliviar la sensibilidad con productos profesionales y de uso en el hogar, se centra en la evidencia clínica sobre la eficacia de las cremas dentales desensibilizantes, y presenta una nueva tecnología de dentífricos innovadora que contiene arginina al 8%, carbonato de calcio y 1,450 ppm de flúor.
La hipersensibilidad dentinaria se caracteriza por un dolor breve y agudo que se origina en la dentina expuesta como respuesta a un estímulo externo y que no puede atribuirse a ninguna otra forma de defecto o enfermedad dental. La teoría hidrodinámica plantea que los estímulos que producen dolor causan un cambio en el flujo del fluido dentinal que, a través de una respuesta de los mecanorreceptores, activa las fibras nerviosas intradentarias y produce dolor. Para sufrir de hipersensibilidad, la dentina debe estar expuesta y los túbulos dentinales deben estar abiertos a los estímulos externos y en comunicación con la pulpa. La recesión gingival es la causa principal de exposición dentinaria, y un factor predisponente importante para la hipersensibilidad dentinaria.
La hipersensibilidad dentinaria es una condición prevalente. Se ha informado que afecta a entre el 15 y el 20% de la población adulta, por lo general a las personas de entre 20 y 50 años, y se observa una mayor incidencia entre los 30 y los 39 años. En algunos estudios, se han informado niveles de prevalencia más altos, de hasta el 57%. Es de esperarse que la incidencia de la hipersensibilidad dentinaria aumente con los cambios en la dieta, y que la prevención de la caries y de la enfermedad periodontal tengan como consecuencia un mejor estado de salud bucal, y conservación y funcionalidad de la dentición.
Los tratamientos para aliviar la hipersensibilidad dentinaria se basan en la interrupción de la respuesta neural a los estímulos dolorosos o en la oclusión de los túbulos abiertos, a fin de bloquear el mecanismo hidrodinámico. La oclusión efectiva y fuerte de la dentina brinda las mejores perspectivas de alivio instantáneo y duradero de la hipersensibilidad dentinaria. En particular los materiales que pueden recubrir las superficies dentinarias expuestas, además de tapar y sellar los túbulos dentinales abiertos, ofrecen una perspectiva interesante para fortalecer la dentina y tornarla menos susceptible a los factores predisponentes, mientras que reducen la hipersensibilidad dentinaria al mismo tiempo.
Se ha demostrado en estudios clínicos que una nueva crema dental que contiene arginina al 8%, carbonato de calcio y 1,450 ppm de flúor como monofluorofosfato de sodio ofrece un aumento significativo de la eficacia en la reducción de la sensibilidad, en comparación con una crema dental líder en el mercado que contiene ion potasio al 2%. En estudios sobre el mecanismo de acción, se ha demostrado que esta tecnología sella físicamente los túbulos dentinales con un tapón que contiene arginina, carbonato de calcio y fosfato. Este tapón, que es resistente a las presiones pulpares normales y a la exposición a los ácidos, reduce, en forma efectiva, el flujo de fluido dentinal y, de este modo, reduce la sensibilidad [J Clin Dent 20 (Spec Iss):1–9, 2009].
Introducción
La hipersensibilidad dentinaria es un problema común de la salud bucal que afecta a uno o más dientes de muchos adultos en todo el mundo. De hecho, hay una toma de conciencia cada vez mayor de que la hipersensibilidad dentinaria es un problema cada vez más importante que debe tratarse, tanto desde el punto de vista del diagnóstico como del manejo del problema, dado que las medidas para el manejo de la caries y la prevención de la enfermedad periodontal son cada vez más exitosas, lo que logra un mejor estado de la salud bucal y una mejor funcionalidad de la dentición durante toda la vida (1).
La hipersensibilidad dentinaria se analizó por primera vez hace más de un siglo cuando Gysi intentó explicar “la sensibilidad de la dentina” y describió el fenómeno del movimiento de fluido en los túbulos dentinales (2). Más de sesenta años después, Brännström propuso la “teoría hidrodinámica” como un mecanismo para explicar la transmisión de los estímulos que producen dolor de la dentina (3, 4). Se han propuesto otras teorías como posibles mecanismos a través de los cuales puede producirse la transmisión del dolor, pero éstas han sido ampliamente descartadas (5, 6).
En 1982 se describió la hipersensibilidad dentinaria como un enigma,dado que se presentaba con frecuencia y no se comprendía con claridad (7). En los últimos veinticinco años se ha visto una evolución en la comprensión científica de esta condición. Principalmente, sobre la base de una sugerencia que se propuso en 1983 (8), el término “hipersensibilidad dentinaria” se definió formalmente en 1997 en las pautas para los ensayos clínicos (9). En 2003, la Junta Asesora Canadiense sobre hipersensibilidad dentinaria (Canadian Advisory Board on Dentin Hypersensitivity) aceptó oficialmente esta definición, con un cambio menor, en sus recomendaciones basadas en el consenso para el diagnóstico y el manejo de la hipersensibilidad dentinaria (10).
Evidentemente, la condición ya no es el enigma que se describió alguna vez. No obstante, existe la necesidad de realizar investigaciones básicas y clínicas en forma continua que mejoren la prevención y el manejo de la hipersensibilidad dentinaria (5).
En la actualidad, existen muchos tratamientos para la sensibilidad que se realizan en el consultorio y cremas dentales para el alivio de la sensibilidad que se comercializan en forma masiva en todo el mundo.
Se ha demostrado en estudios clínicos la efectividad de algunos productos de uso en el consultorio, p. ej., barniz con fluoruro de sodio al 5% (11); no obstante, no hay suficiente información sobre la mayoría de estos productos (5, 12). Parece haber una gran cantidad de datos clínicos que respaldan la eficacia de los dentífricos a base de potasio, y se ha reconocido que estos productos proporcionan alivio a las personas que los usan (13). Sin embargo, algunos autores llegaron a la conclusión de que los datos son cuestionables (6, 13). A pesar de la prevalencia reportada de la hipersensibilidad dentinaria, cabe destacar que un porcentaje relativamente pequeño de personas que sufren sensibilidad buscan tratamiento profesional para el alivio de su condición y/o usan diariamente una crema dental para el alivio de la sensibilidad (10).
Esta revisión ha identificado muchas oportunidades para mejorar la prevención y el manejo de la hipersensibilidad dentinaria: en primer lugar, ampliando el conocimiento de los fundamentos científicos de la hipersensibilidad dentinaria; en segundo lugar, comunicando los factores de riesgo relacionados con la hipersensibilidad dentinaria a los profesionales y consumidores, y cómo reducir el riesgo y prevenir el daño que puede provocar la hipersensibilidad dentinaria; y, en tercer lugar, desarrollando y validando productos para el alivio de la sensibilidad profesionales y para uso en el hogar verdaderamente efectivos para el alivio de la sensibilidad.
Este artículo proporciona una breve descripción del diagnóstico, la etiología y la epidemiología de la hipersensibilidad dentinaria, su manejo clínico, y los productos disponibles para aliviar la condición.
Además, presenta el desarrollo y la validación de una nueva tecnología para el alivio de la sensibilidad que se basa en la arginina y el carbonato de calcio. En los siguientes dos trabajos incluidos en este Número especial, de Ayad, et ál. y Docimo, et ál., reportan los resultados de dos estudios clínicos de ocho semanas sobre un nuevo dentífrico que contiene arginina al 8%, carbonato de calcio y 1,450 ppm de flúor como monofluorofosfato de sodio. En estos estudios, se demostró que este dentífrico brinda un mayor alivio de la sensibilidad en comparación con un dentífrico líder en el mercado que contiene ion potasio al 2% como agente contra la sensibilidad. En el trabajo final, de Petrou, et ál., se presenta evidencia del mecanismo de acción de la tecnología con arginina-carbonato de calcio para formar un tapón sólido para sellar físicamente los túbulos dentinales abiertos, deteniendo así el movimiento del fluido y reduciendo la sensibilidad.
Desde la definición hasta el diagnóstico de la hipersensibilidad dentinaria
Principalmente, sobre la base de una interpretación desarrollada en 1983 (8), se propuso la definición de hipersensibilidad dentinaria en 1997 (9) y, con un ajuste menor fue aceptada en 2003 (10). La definición actual es la siguiente: “La hipersensibilidad dentinaria se caracteriza por un dolor breve y agudo que se origina en la dentina expuesta en respuesta a un estímulo, por lo general, térmico, de presión de aire, táctil, osmótico o químico, y que no puede atribuirse a ninguna otra forma de defecto o enfermedad dental” (5, 10). En 2002, la Federación Europea de Periodoncia (European Federation of Periodontology) adoptó el término “sensibilidad radicular” para describir la sensibilidad dental relacionada con el tratamiento de la enfermedad periodontal, dado que no se sabe con exactitud si esta forma de sensibilidad es verdaderamente hipersensibilidad dentinaria (5).
Para los médicos, una consecuencia importante de la definición de hipersensibilidad dentinaria es que se debe prestar especial atención al realizar el diagnóstico diferencial para excluir todos los demás defectos o enfermedades dentales que puedan provocar presentaciones similares de dolor dentario. Ya se han descrito en detalle los factores que se deben tener en cuenta al realizar el diagnóstico de hipersensibilidad dentinaria, como la presencia de caries dental, dientes partidos o fracturas cuspídeas, cuestiones relacionadas con el uso de medicamentos y sensibilidad por blanqueamiento (5, 13, 14).
 |
Basta decir que es esencial realizar un diagnóstico diferencial y atribuir en forma correcta el dolor dental a la hipersensibilidad dentinaria, a fin de evaluar las opciones de tratamiento apropiadas para esta y otras condiciones que provocan dolor (13, 15).
Mecanismos de sensibilidad, etiología y factores predisponentes en la hipersensibilidad dentinaria
El dolor que se experimenta con más frecuencia a causa de la hipersensibilidad dentinaria se caracteriza por un episodio de dolor agudo, de aparición rápida y de duración breve (segundos o minutos), esto se asocia con respuestas de las fibras nerviosas A-beta y A-delta a los estímulos (5, 6, 16).
En la actualidad, se acepta la teoría hidrodinámica como el mecanismo a través del cual se produce la hipersensibilidad dentinaria.
Dicha teoría sugiere que la hipersensibilidad dentinaria es el resultado del movimiento del fluido dentro de los túbulos dentinales. La mayoría de los estímulos más problemáticos que producen dolor, en particular los estímulos frío y de aire a presión, provocan una fuga de fluido dentinal (5, 17, 18). Esto produce un cambio en la presión a través de la dentina que, mediante una respuesta de los mecanorreceptores, activa las fibras nerviosas intradentarias y causa dolor. Además, el movimiento de fluido en los túbulos puede producir una descarga eléctrica conocida como “potencial del flujo”, que puede contribuir estimulando en forma eléctrica una respuesta nerviosa (5). En contraposición, el calor produce un retroceso relativamente lento del fluido dentinal, y los cambios de presión resultantes activan las fibras nerviosas en forma menos drástica, lo que es coherente con el hecho de que, por lo general, el calor es un estímulo menos problemático que el frío (5).
El mecanismo hidrodinámico necesita que los túbulos dentinales estén abiertos en la superficie dentinaria y en comunicación con la pulpa. En estudios con microscopía electrónica de barrido y de penetración de la tinción en dientes exfoliados, con áreas de dentina expuesta caracterizadas desde el punto de vista clínico como “sensibles” y “no sensibles”, se ha demostrado que, en los dientes “sensibles”, hay una mayor cantidad (ocho veces más) de túbulos, que estos tienen un mayor diámetro (dos veces más) y están abiertos, mientras que, en los dientes “no sensibles”, hay una menor cantidad de túbulos, estos tienen un menor diámetro y, por lo general, están cerrados (19, 20). Dado que la tasa de flujo de fluido a través de los túbulos dentinales es proporcional al radio de los túbulos elevado a la cuarta potencia, es muy probable que la diferencia en el diámetro de los túbulos entre los dientes “sensibles” y los “no sensibles” sea relevante desde el punto de vista clínico para el tratamiento de la hipersensibilidad dentinaria (5). Curiosamente, también se ha reportado que la cantidad de túbulos dentinales y su diámetro aumentan desde la superficie externa de la dentina hasta la unión interna con la pulpa, lo que sugiere que la hipersensibilidad dentinaria podría empeorar a medida que la dentina se pierde progresivamente por el desgaste dentario (5).
Para que se produzca hipersensibilidad dentinaria, la dentina debe quedar expuesta (proceso denominado “localización de la lesión”) y los túbulos dentinales deben estar abiertos y en comunicación con la pulpa (proceso denominado “inicio de la lesión”) (5,12). Estos dos procesos son multifactoriales.
Una importante vía a través de la cual la dentina puede quedar expuesta es la recesión gingival. La recesión gingival es una condición multifactorial que puede volverse más compleja por factores anatómicos (21). El cepillado excesivo y el cepillado inadecuado se han asociado con daño gingival y pérdida del tejido gingival debido a fuerzas mecánicas (5). Por otro lado, la enfermedad periodontal y otras condiciónes periodontales relacionadas, junto con procedimientos de tratamiento quirúrgico y no quirúrgico, se han asociado con daño en el tejido periodontal y pérdida del tejido gingival debido a procesos de degradación biológica (22).
Una vez que se produce la recesión gingival, por cualquiera de sus causas, el cemento que cubre la superficie dentinal es eliminado fácilmente mediante fuerzas físicas y/o químicas, lo que deja expuesta la dentina subyacente (5).
Una segunda vía a través de la cual la dentina puede quedar expuesta es la pérdida del esmalte. Se ha demostrado a partir de nuevas investigaciones en el campo de los procesos mecánicos y químicos del desgaste dental que la abrasión y la erosión ácida pueden exacerbar la pérdida del esmalte. Se ha demostrado en estudios in vitro e in situ detallados que el proceso mecánico de cepillado con cepillo de dientes únicamente no produce efectos medibles en el esmalte, y que el cepillado con crema dental contribuye muy poco, o nada, con la pérdida del esmalte después del uso durante toda la vida (5). En contraposición, el proceso químico de erosión por alimentos y bebidas ácidos puede producir un desgaste dentario significativo y exposición de la dentina en cualquier cara de la superficie dentaria (5,12). Cabe destacar que se cree que la exposición dentinaria producida por la pérdida del esmalte en zonas propensas a sufrir hipersensibilidad dentinaria, es decir en la zona cervical, es el resultado de la erosión ácida dietaria en combinación con el cepillado (23, 24). Se ha demostrado a partir de estudios in vitro sobre mecánica que la exposición del esmalte a ácidos extrínsecos produce una pérdida directa de los minerales de la superficie, así como un ablandamiento de la superficie del esmalte (25, 26), y que este frágil tejido de superficie ablandada puede eliminarse fácilmente con niveles bajos de fuerza física (27). La experiencia clínica sugiere que la recesión gingival, y no la pérdida del esmalte cervical, es la principal causa de exposición dentinaria y, por lo tanto, es el factor predisponente clave de la hipersensibilidad dentinaria (5).
La dentina cuenta con una protección natural, y los túbulos dentinales expuestos están ocluidos por un recubrimiento conocido como “barro dentinario” que contiene componentes proteicos y depósitos de fosfato de calcio derivados de la saliva. En principio, cualquier fuerza física o química que pueda eliminar el barro dentinario puede abrir los túbulos dentinales y dar inicio a una lesión de hipersensibilidad. Sobre la base de estudios in vitro, Addy ha sugerido que el cepillado con crema dental puede eliminar en forma física el barro dentinario y abrir los túbulos dentinales expuestos (5). No obstante, en la bibliografía, no se cuenta con estudios clínicos especializados que validen estas observaciones realizadas in vitro. En contraposición, existen datos clínicos disponibles en la actualidad que sugieren que la eliminación física del barro dentinario y la apertura de los túbulos dentinales expuestos no son un factor clave con el cepillado normal. Por otro lado, parece haber pocas dudas de que los alimentos y las bebidas ácidos tienen la capacidad de eliminar la capa de barro dentinario reduciendo así sus efectos protectores, y de ablandar la dentina, haciendo que el tejido dentinario con superficie ablandada sea susceptible a las fuerzas físicas, como el cepillado.
La evidencia actual sugiere que la erosión ácida es un factor importante en la apertura de los túbulos dentinales expuestos; no obstante, la abrasión puede tener un efecto agravante (5, 17).
Prevalencia de la hipersensibilidad dentinaria
La hipersensibilidad dentinaria puede presentarse ya en la adolescencia, pero se observa más comúnmente en la población adulta (17).
En estudios sobre la prevalencia de hipersensibilidad dentinaria, se han reportado niveles ampliamente diferentes, que oscilan entre el 4 y el 57%, en personas pertenecientes al ámbito de la práctica odontológica general (5, 12, 13, 17). Estas amplias variaciones se han atribuido a una serie de factores, incluido el método de evaluación o diagnóstico, la base y los escenarios poblacionales, y los factores del comportamiento tales como los hábitos de higiene bucal y la ingesta de alimentos y bebidas ácidos.
Una gran encuesta mundial, realizada en 2002, mostró niveles autoreportados de sensibilidad en un rango de entre el 37 y el 52% (28), mientras que una serie de encuestas anteriores sugirió una prevalencia de aproximadamente el 15% (29). También se ha informado que los niveles de hipersensibilidad dentinaria detectados varían entre los diferentes profesionales, los higienistas detectan niveles casi dos veces mayores que los detectados por los odontólogos (10). Los expertos han sugerido que las encuestas a los pacientes sobreestiman la prevalencia de hipersensibilidad dentinaria, dado que los exámenes clínicos llevados a cabo cuidadosamente por examinadores dentales entrenados mostraron, de manera uniforme, niveles de prevalencia más bajos (5, 30-32).
No obstante, en un resumen reciente de estudios, se observó un rango más amplio de valores de prevalencia (4-74%) para estudios en los que se usó el diagnóstico clínico (33). No resulta sorprendente que los niveles de sensibilidad radicular sean mayores, entre el 60 y el 98%, en pacientes que recibieron tratamiento periodontal (5, 13, 22).
Parece ser que hay una incidencia levemente mayor de hipersensibilidad dentinaria en mujeres que en los hombres, lo que posiblemente refleje las prácticas de higiene bucal y dietarias. La mayor parte de las personas que sufren hipersensibilidad dentinaria se encuentran en el rango de entre 20 y 49 años, con una incidencia máxima entre los 30 y los 39 años (5, 13). Los niveles más bajos de hipersensibilidad dentinaria en personas mayores se deben, muy probablemente, a procesos reparadores que reducen la permeabilidad y reducen la conductancia hidráulica, como la formación de una dentina secundaria17. Las áreas cervicales vestibulares de los dientes permanentes son las más comúnmente afectadas, y se ha reportado que los caninos, los premolares y los incisivos se ven afectados con mayor frecuencia que los molares (5). Esta distribución de la hipersensibilidad dentinaria es notablemente coherente con la incidencia de recesión gingival. Una vez más, esto sugiere que la recesión gingival es la principal causa de exposición dentinaria y un importante factor predisponente de la hipersensibilidad dentinaria (5, 13).
Manejo clínico de la hipersensibilidad dentinaria
En marcada contraposición con la caries y la enfermedad periodontal, cuyo manejo surge de décadas de investigación y medidas de prevención y tratamiento basadas en la evidencia y bien establecidas, la hipersensibilidad dentinaria se ha manejado sobre una base empírica. Asimismo, los enfoques para el manejo de la hipersensibilidad dentinaria se han centrado principalmente en el tratamiento y, hasta el momento, no han hecho mucho énfasis en la prevención.
Los avances en el conocimiento científico que se produjeron en los últimos veinte años permiten, en la actualidad, un enfoque más integral en el manejo de la hipersensibilidad dentinaria, que abarca el control de sus factores etiológicos y predisponentes. De hecho, se han propuesto estrategias de manejo que incluyen: 1) diagnóstico correcto, compatible con la descripción clínica de hipersensibilidad dentinaria, basado en la historia y el examen; 2) diagnóstico diferencial, para descartar otras condiciones que podrían provocar un dolor similar; 3) tratamiento de todas las condiciones secundarias que producen síntomas similares a los de la hipersensibilidad dentinaria; 4) identificación de factores etiológicos y predisponentes, en particular, hábitos dietarios y de higiene bucal relacionados con la erosión y la abrasión; 5) eliminación o minimización de factores etiológicos y predisponentes mediante asesoramiento dietario e instrucción sobre la higiene bucal; y 6) recomendación o administración de tratamiento sobre la base de las necesidades individuales (5).
 |
Es de particular pertinencia para este artículo la etapa 6 de esta estrategia de manejo propuesta, es decir, el tratamiento de la hipersensibilidad dentinaria con base en las necesidades individuales. Un primer paso es recomendar el uso de una crema dental desensibilizante, dado que, por lo general, esto produce mejorías en la mayoría de las personas.
Cuando no es suficiente el uso de una crema dental desensibilizante, la formulación de productos fluorados para uso en el hogar puede proporcionar beneficios adicionales a los que brinda la crema dental para el alivio de la sensibilidad y, por lo tanto, puede ser útil como segundo paso; la aplicación de productos por parte de un profesional puede ser adecuada para pacientes con necesidades adicionales de tratamiento (10).
Productos para aliviar la hipersensibilidad dentinaria
Se han utilizado dos enfoques de tratamiento para proporcionar alivio de la hipersensibilidad dentinaria: uno es interrumpir la respuesta neural a los estímulos dolorosos; el otro es ocluir los túbulos abiertos para bloquear el mecanismo hidrodinámico.
El principio de interrumpir la respuesta neural a los estímulos dolorosos se ha aplicado principalmente en el desarrollo y la validación de cremas dentales desensibilizantes. En la actualidad, las cremas dentales desensibilizantes representan entre el 8 y el 10% del mercado global de cremas dentales. La gran mayoría de estos productos contienen una sal de potasio para “adormecer” el dolor producido por la hipersensibilidad dentinaria (34, 35). La mayoría de las cremas dentales a base de potasio contienen también flúor para la protección contra la caries; algunas contienen otros ingredientes para proporcionar beneficios adicionales, como control de cálculos y blanqueamiento.
La Administración de Drogas y Alimentos (Food and Drug Administration, FDA) de los Estados Unidos ha revisado los datos clínicos sobre la eficacia de las cremas dentales con nitrato de potasio al 5% y, sobre la base de su seguridad y eficacia comprobada para reducir la hipersensibilidad dentinaria, ha clasificado las cremas dentales con nitrato de potasio como desensibilizantes dentales seguros y efectivos en la monografía final tentativa (36). En muchos países, el nitrato de potasio (5%), el cloruro de potasio (3.75%) y el citrato de potasio (5.5%) se utilizan en las cremas dentales desensibilizantes en forma intercambiable, dado que cada una de estas sales proporciona el ion potasio al 2% que es el principio activo desensibilizante.
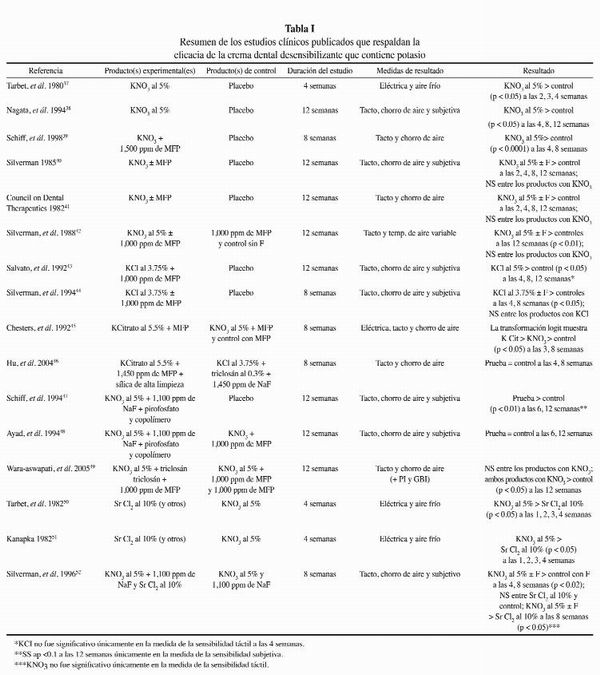
Se ha demostrado en ensayos clínicos que con las cremas dentales a base de potasio se requiere el uso dos veces por día durante, por lo menos, dos semanas para obtener reducciones medibles en la sensibilidad y períodos más prolongados, por lo general, de entre cuatro y ocho semanas, para mostrar niveles significativos de alivio del dolor. Los datos clínicos respaldan que las tres formas de potasio, nitrato (37-42,45,47-52), cloruro (43, 44), y citrato (45, 46), son efectivas para reducir la hipersensibilidad dentinaria, en comparación con una crema dental con flúor común. Estudios clínicos también han mostrado que el agregado de flúor a una crema dental a base de potasio para la protección contra la caries, no afecta en forma negativa la eficacia del alivio de la sensibilidad (40-42,44). Del mismo modo, se ha demostrado en estudios clínicos que el agregado de otros agentes beneficiosos, como ingredientes para el control de la placa y los cálculos, a cremas dentales a base de potasio no afecta la eficacia (47-49).
En la Tabla I, se proporciona un resumen de estos estudios clínicos.
Esta revisión ha identificado evidencia publicada que respalda las formulaciones de cremas dentales que contienen potasio como efectivas para reducir la hipersensibilidad dentinaria. No obstante, algunos investigadores clínicos han informado que las cremas dentales a base de potasio no son más efectivas que las cremas dentales con flúor comunes (53-55), lo que sugiere que la evidencia clínica que respalda la eficacia de las cremas dentales desensibilizantes es cuestionable (6, 13, 56, 57).
Las diferencias en los resultados clínicos pueden atribuirse a la diversidad entre los protocolos clínicos y al bien conocido efecto placebo o al efecto Hawthorne. El hecho de que los productos placebo pueden reducir la sensibilidad en hasta un 40% con respecto al inicio ha afectado en forma significativa la capacidad de diferenciar, en algunos estudios, la eficacia del producto experimental (6, 57).
El principio de ocluir los túbulos abiertos para bloquear el mecanismo hidrodinámico se ha aplicado ampliamente en los productos de uso profesional en el consultorio y de uso en el hogar58.
No obstante, se ha aplicado en forma limitada en las cremas dentales desensibilizantes. El cloruro de estroncio (10%) fue el primer ingrediente bloqueante de los túbulos que se utilizó en cremas dentales. Aún puede encontrarse en unas pocas marcas en algunos mercados, pero ha sido desplazado ampliamente por la introducción del potasio. Por este motivo, existen pocos datos clínicos sobre la eficacia de los productos con cloruro de estroncio. En la Tabla I, se resumen los pocos estudios disponibles. Estos datos respaldan la conclusión de que las cremas dentales con cloruro de estroncio son menos efectivas para reducir la hipersensibilidad dentinaria que las cremas dentales con nitrato de potasio50-52. También se ha utilizado el fluoruro de estaño en algunos productos desensibilizantes. Se ha demostrado que las formulaciones de hidrogel y crema dental son efectivas para reducir la sensibilidad en comparación con productos de control placebo (59-64). Por lo general, se ha demostrado que estas formulaciones proporcionan reducciones significativas de la hipersensibilidad dentinaria después del uso dos veces por día, durante cuatro semanas (59-62).
No se han publicado estudios comparativos directos sobre la eficacia del potasio frente al estaño como agentes desensibilizantes. A pesar de su eficacia comprobada, el fluoruro de estaño no ha estado disponible ampliamente en el mercado de las cremas dentales para la sensibilidad.
Existen varios motivos para esto, entre los que se pueden mencionar dos factores negativos bien conocidos: las manchas de los dientes y el sabor desagradable. Se cree que tanto el estroncio como el estaño actúan precipitando los compuestos metálicos insolubles en las superficies dentinarias y, de esta forma, ocluyen parcialmente los túbulos dentinales abiertos. En contraposición con la tecnología de arginina-carbonato de calcio descrita en este Número Especial y que se resume a continuación, los productos con estroncio y estaño no brindan una solución para la hipersensibilidad dentinaria mediante el estímulo del depósito del calcio y del fosfato “naturales”.
Desarrollo y validación de una nueva tecnología para el alivio de la sensibilidad
Recientes avances en el conocimiento de la etiología de la hipersensibilidad dentinaria han llevado a reconocer la importancia de diseñar nuevos tratamientos que ataquen las causas subyacentes y que también traten los síntomas de la hipersensibilidad dentinaria. Se ha sugerido que las investigaciones futuras deben centrarse en el desarrollo y la validación de nuevos materiales que puedan hacer que la superficie dentinaria se vuelva significativamente más resistente al ataque mecánico y químico. Específicamente, se ha propuesto que aumentar la densidad mineral de la superficie de la dentina podría mejorar la resistencia al desgaste, mientras que tapar y sellar los túbulos abiertos con una sustancia similar a la dentina que contenga calcio y fosfato podría aumentar la resistencia al desgaste y también podría aumentar la resistencia a los ácidos mediante el bloqueo de su difusión a través de los túbulos hacia la subsuperficie dentinaria.
En una revisión reciente de los enfoques biológicos de la terapia, se ha propuesto que el tratamiento ideal para la hipersensibilidad dentinaria debería imitar el proceso natural de desensibilización que se produce sin intervención y que, con el tiempo, produce la oclusión espontánea de los túbulos dentinales abiertos. Los autores sugirieron que un tratamiento exitoso debería hacer que la dentina tratada quede sin sensibilidad y se vuelva esclerótica, dado que este estado es preferible a una dentina abierta, permeable y sensible. Concluyeron que cualquier tratamiento que selle por completo los túbulos dentinales restaurará dicha superficie a un estado saludable6.
La saliva cumple una función en la reducción natural de la hipersensibilidad dentinaria; en primer lugar, a través del transporte de calcio y fosfato hacia los túbulos dentinales para inducir el sellamiento tubular; y, en segundo lugar, mediante la formación de una capa protectora de la superficie compuesta por glicoproteína salival con calcio y fosfato. El pH alcalino favorece ambos procesos; por ello, se ha sugerido que los factores salivales que mantienen un pH levemente alcalino in vivo favorecen la oclusión. Dado que los procesos naturales no son suficientes para inducir la oclusión rápida y reducir la hipersensibilidad dentinaria en la mayoría de las personas, las investigaciones científicas que respaldan estos mecanismos llevaron al desarrollo de una nueva “composición basada en la saliva” para el tratamiento de la hipersensibilidad dentinaria (65). Los componentes esenciales de esta tecnología son la arginina, un aminoácido con carga positiva a pH fisiológico, es decir, pH 6.5–7.5; bicarbonato, un amortiguador del pH; y carbonato de calcio, que es una fuente de calcio. En los Estados Unidos se ha presentado recientemente en el mercado un producto basado en esta composición (ProClude®, Ortek Therapeutics, Roslyn Heights, NY, EE. UU.) para el manejo de la sensibilidad de los dientes durante el tratamiento para profilaxis realizado por el profesional. Se ha demostrado en estudios clínicos (65) que esta pasta de profilaxis desensibilizante es efectiva para proporcionar un alivio instantáneo de la sensibilidad cuando se bruñe en los dientes sensibles después de procedimientos de raspaje y alisado radicular, y que este alivio de la sensibilidad dura, al menos, 28 días después de un único tratamiento. Además, en estudios in vitro sobre el mecanismo de acción, se ha demostrado la oclusión de los túbulos65. También se incorporó la composición a una crema dental (comercializada en los Estados Unidos como DenClude®, Ortek Therapeutics, Roslyn Heights, NY, EE. UU.) para su uso en el hogar después del tratamiento profesional.
Colgate-Palmolive siguió desarrollando esta tecnología innovadora combinando los componentes clave, arginina y carbonato de calcio, con flúor. Durante la primera etapa de este desarrollo, se demostró en dos estudios clínicos que una crema dental experimental que contiene arginina al 4%, carbonato de calcio y 1,450 ppm de flúor como monofluorofosfato de sodio es efectiva para reducir la hipersensibilidad dentinaria; los resultados de estos estudios se resumen en este trabajo y se presentan en las Tablas II–V a continuación.
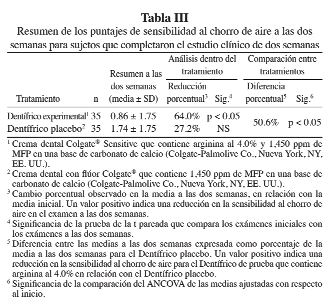 |
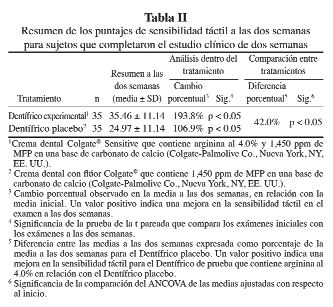
El primero de estos estudios fue un estudio clínico de dos semanas, a doble ciego, con grupos paralelos, aleatorizado en el cual esta crema dental experimental (prueba) con arginina al 4% se comparó con una crema dental de control similar sin arginina (66). Setenta sujetos completaron el estudio. No se observaron diferencias significativas en los puntajes de sensibilidad táctil (prueba = 12.00 ± 4.57 y control = 12.14 ± 5.04) y al chorro de aire (prueba = 2.47 ± 0.44 y control = 2.31 ± 0.44) entre los productos experimentales y de control con respecto al inicio. En las Tablas II y III, se muestran los puntajes de este estudio a las dos semanas. Los resultados muestran que la crema dental experimental con arginina al 4% produjo reducciones significativas desde el punto de vista estadístico en los puntajes de sensibilidad táctil (42.0%) y al chorro de aire (50.6%), en comparación con el producto de control, después de dos semanas de uso.
El segundo de estos dos estudios (66) fue un estudio clínico, de ocho semanas, a doble ciego, con grupos paralelos, aleatorizado, en el que la misma crema dental experimental con arginina al 4% se comparó con la crema dental desensibilizante que se comercializa en la actualidad, Sensodyne® Total Care F (GlaxoSmithKline, Middlesex, R. U.), que contiene cloruro de potasio al 3.75% y 1,450 ppm de flúor de sodio (NaF), como control positivo. Setenta y nueve sujetos completaron el estudio.
No se observaron diferencias significativas en los puntajes de sensibilidad táctil (prueba = 12.63 ± 3.75 y control = 12.05 ± 3.76) y al chorro de aire (prueba = 2.56 ± 0.43 y control = 2.64 ± 0.38) entre los productos experimentales y de control con respecto al inicio. En las Tablas IV y V, se muestran los puntajes de este estudio a las ocho semanas. Los resultados muestran que la crema dental experimental con arginina al 4% produjo reducciones significativas desde el punto de vista estadístico en los puntajes de sensibilidad táctil (14.7%) y al chorro de aire (27.0%), en comparación con el producto de control, después de ocho semanas de uso.
Para cumplir con el objetivo de proporcionar una alta eficacia para el tratamiento de la hipersensibilidad dentinaria en relación con la crema dental desensibilizante que se comercializa en la actualidad después de dos semanas de cepillado dos veces por día, se ha desarrollado una nueva fórmula con arginina al 8%, carbonato de calcio y 1,450 ppm de flúor como monofluorofosfato de sodio. Se validó la nueva fórmula en dos ensayos clínicos sobre la hipersensibilidad dentinaria (67, 68) y en los estudios sobre el mecanismo de acción (69) que se resumen a continuación y se analizan en detalle en los próximos artículos.
Los dos estudios clínicos demostraron que el dentífrico que contiene arginina al 8%, carbonato de calcio y 1,450 ppm de flúor proporciona un mayor alivio de la sensibilidad en relación con el dentífrico líder en el mercado que contiene ion potasio al 2%, como cloruro de potasio al 3.75%. En un estudio de ocho semanas que se llevó a cabo en Canadá, la crema dental con arginina al 8% produjo reducciones significativas desde el punto de vista estadístico en la hipersensibilidad dentinaria en respuesta a las medidas de la sensibilidad táctil (16.2%, 22.4%y 21.4%) y al chorro de aire (16.2%, 29.2% y 63.4%) en comparación con Sensodyne Total Care F a las dos, cuatro y ocho semanas, respectivamente (67).
Del mismo modo, en un estudio de ocho semanas llevado a cabo en Italia, la misma crema dental con arginina al 8% proporcionó reducciones significativas desde el punto de vista estadístico en la hipersensibilidad dentinaria en respuesta a las medidas de la sensibilidad táctil (37.0%, 30.0% y 12.2%) y al chorro de aire (23.9%, 32.0% y 29.3%) en comparación con Sensodyne Total Care F a las dos, cuatro y ocho semanas, respectivamente (68). Estos dos estudios clínicos muestran una coherencia notable en los resultados, lo que demuestra que el dentífrico que contiene arginina al 8%, carbonato de calcio y 1,450 ppm de flúor tiene mayor eficacia para reducir la hipersensibilidad dentinaria en comparación con un dentífrico líder en el mercado que contiene ion potasio al 2% a las dos, cuatro y ocho semanas, en las medidas de la sensibilidad táctil y al chorro de aire.
Se han utilizado diversos métodos de diagnóstico por imágenes de última tecnología para dilucidar aspectos del mecanismo de acción de la tecnología arginina-carbonato de calcio. Se ha demostrado en estudios con Microscopía confocal láser de barrido (Confocal Laser Scanning Microscopy, CLSM) que la pasta de profilaxis desensibilizante con arginina al 8% y el dentífrico con arginina al 8% tienen el mismo mecanismo de acción, y que ambos son altamente efectivos para ocluir los túbulos dentinales abiertos. No se observó oclusión dentinaria con las cremas dentales de control; una contenía carbonato de calcio solo, la otra contenía arginina al 8% y un abrasivo de calcio alternativo, dihidrato de fosfato dicálcico (Dical). Se ha demostrado en estudios con CLSM, utilizando una tinción de unión de isotiocianato de fluoresceína (fluorescein isothiocyanate, FITC) para localizar la arginina, que la arginina llega a las superficies internas de los túbulos dentinales dentro del tapón dentinario ocluido. Además, estudios con CLSM han demostrado que la oclusión lograda es resistente a la exposición a los ácidos (69), como las bebidas carbonatadas.
Las imágenes de microscopía electrónica de barrido (Scanning ElectronMicroscopy, SEM) de alta resolución confirmaron que la pasta de profilaxis desensibilizante produce la oclusión completa de los túbulos dentinales abiertos, y las imágenes de criofractura han demostrado que el tapón alcanza una profundidad de dos micrones en el túbulo. El mapeo químico de las superficies ocluidas utilizando rayos X por energía dispersiva (Energy Dispersive X-ray, EDX) ha demostrado que el material que está en la superficie dentinaria y ocluido dentro de los túbulos dentinales está formado principalmente por calcio y fosfato.
Estudios en los que se utilizó espectroscopía de electrones para análisis químico (Electron Spectroscopy for Chemical Analysis, ESCA) proporcionaron datos cuantitativos que confirmaron estas observaciones y, además, identificaron la presencia de carbonato (69).
Se utilizó microscopía de fuerza atómica (Atomic Force Microscopy, AFM) para confirmar el mecanismo de bloqueo. Las imágenes de las muestras no tratadas mostraron la estructura helicoidal fina de la dentina intertubular, así como túbulos que estaban completamente abiertos. Las imágenes de las muestras tratadas con pasta de profilaxis desensibilizante mostraron que la estructura helicoidal en la superficie dentinaria ya no era visible como resultado del recubrimiento de la superficie, y que los túbulos estaban sellados y cerrados (69).
 |
En conjunto, estos resultados demostraron claramente que tanto la pasta de profilaxis desensibilizante con arginina al 8% como el dentífrico con arginina al 8% reducen la hipersensibilidad dentinaria sellando y tapando los túbulos dentinales. Kleinberg sugirió que la arginina se adsorbe en forma física a la superficie del carbonato de calcio in vivo, formando un aglomerado con carga positiva que se une rápidamente a la dentina con carga negativa en las superficies expuestas y dentro de los túbulos. Además, Kleinberg sugirió que el pH del aglomerado de arginina-carbonato de calcio es lo suficientemente alcalino como para facilitar la intervención natural a través del depósito de calcio y fosfato de la saliva y/o del fluido dentinal (65). Los resultados de los estudios sobre el mecanismo de acción, que se resumen en el presente trabajo y se presentan en detalle en el trabajo de Petrou, et ál. (69), son coherentes con las hipótesis de Kleinberg y respaldan que la interacción de la arginina con el carbonato de calcio in vivo desencadena el depósito de fosfato, además de arginina, calcio y carbonato, en la superficie dentinaria y dentro de los túbulos dentinales (69).
Por último, los experimentos de conductancia hidráulica evaluaron si el tratamiento con la crema dental que contiene arginina al 8%, carbonato de calcio y 1,450 ppm de flúor es efectivo no sólo para ocluir los túbulos dentinales, sino también para bloquear el movimiento de fluido, a fin de inhibir el mecanismo hidrodinámico. Estos experimentos mostraron que los tratamientos secuenciales con la crema dental produjeron reducciones en la permeabilidad dentinaria del 63% después de un tratamiento y del 82% después de 14 tratamientos.
Asimismo, estos estudios mostraron que la oclusión dentinaria es fuerte, dado que se mantuvo la reducción de la permeabilidad después de siete días de presión pulpar (79%) y después del tratamiento con ácido fuerte (77%) (69).
 |
Resumen y conclusiones
El presente trabajo brinda un resumen general de la información con la que se cuenta en la actualidad en relación con el diagnóstico, la epidemiología, la etiología y el manejo clínico de la hipersensibilidad dentinaria. Resume los enfoques técnicos que se aplican para aliviar la sensibilidad en productos profesionales y de uso en el hogar, se centra especialmente en la evidencia clínica sobre la eficacia de las cremas dentales desensibilizantes, y presenta una nueva tecnología de dentífricos innovadora que se basa en la arginina y el carbonato de calcio.
La recesión gingival, una condición multifactorial compleja, es la causa principal de exposición dentinaria y un importante factor predisponente de la hipersensibilidad dentinaria. La erosión del esmalte producida por alimentos y bebidas ácidos puede contribuir a la exposición dentinaria, aunque parece tener una función secundaria a la recesión gingival en la exposición de la dentina en el margen cervical.
No obstante, la erosión ácida casi con certeza tiene una función más importante en la apertura de los túbulos dentinales expuestos.
Se han utilizado dos enfoques de tratamiento para proporcionar alivio de la hipersensibilidad dentinaria: uno es interrumpir la respuesta neural a los estímulos dolorosos; y el otro es ocluir los túbulos abiertos para bloquear el mecanismo hidrodinámico. La oclusión efectiva y fuerte de la dentina brinda las mejores perspectivas de alivio instantáneo y duradero de la hipersensibilidad dentinaria. Específicamente, se ha propuesto que aumentar la densidad mineral de la superficie de la dentina podría mejorar la resistencia al desgaste, mientras que tapar y sellar los túbulos abiertos con una sustancia similar a los minerales de los dientes que contenga calcio y fosfato podría aumentar la resistencia al desgaste y también podría aumentar la resistencia a los ácidos mediante el bloqueo de la difusión a la subsuperficie dentinaria (6). En conjunto, estos dos efectos podrían fortalecer la dentina y tornarla menos susceptible a los factores predisponentes, especialmente la erosión ácida, reduciendo así el riesgo de hipersensibilidad dentinaria.
Se ha desarrollado una nueva tecnología innovadora basada en la arginina y el carbonato de calcio y se ha validado como un tratamiento único y altamente efectivo para la hipersensibilidad dentinaria. Los datos clínicos de dos estudios independientes muestran que una crema dental que contiene arginina al 8%, carbonato de calcio y 1,450 ppm de flúor como monofluorofosfato de sodio ofrece una eficacia superior para reducir la sensibilidad, en comparación con un dentífrico líder que contiene ion potasio al 2% como agente desensibilizante. En estudios sobre el mecanismo de acción se ha demostrado que esta tecnología innovadora funciona sellando físicamente los túbulos dentinales con un tapón que contiene arginina, carbonato de calcio y fosfato. Este tapón, que es resistente a las presiones pulpares normales y a la exposición a los ácidos, reduce, en forma efectiva, el flujo de fluido dentinal y, de este modo, reduce la sensibilidad.
Correspondencia
Dra. Diane Cummins
diane_cummins@colpal.com.
Bibliografía
1. Banoczy J: Dentine hypersensitivity—General considerations for successful practice management. Int Dent J 52 (Suppl 5):366, 2002.
2. Gysi A: An attempt to explain the sensitiveness of dentin. Br J Dent Sci 43:865–868, 1900.
3. Brännström M: A hydrodynamic mechanism in the transmission of painproduced stimuli through the dentine. En: Sensory Mechanisms in Dentine. Anderson DJ, ed., Pergamon Press, London, pp. 73–79, 1963.
4. Brännström M, Johnson G: Movements of the dentine and pulp liquids on application of thermal stimuli. Acta Odontol Scand 28:59–70, 1970.
5. Addy M: Dentine hypersensitivity: New perspectives on an old problem. Int Dent J 52 (Suppl):367–375, 2002.
6. Markowitz K, Pashley DH: Discovering new treatments for sensitive teeth: The long path from biology to therapy. J Oral Rehab 35:300–315, 2007.
7. Johnson RH, Zulgar-Nain BJ, Koval JJ: The effectiveness of an electro- ionizing toothbrush in the control of dentinal hypersensitivity. J Periodontol 53:353–359, 1982.
8. Dowell P, Addy M: Dentine hypersensitivity – A review. Aetiology, symptoms and theories of pain production. J Clin Periodontol 10:341–350, 1983.
9. Holland GR, Närhi MN, Addy M, Gangerosa L, Orchardson R: Guidelines for the design and conduct of clinical trials on dentine hypersensitivity. J Clin Periodontol 24:808–813, 1997.
10. Canadian Advisory Board on Dentin Hypersensitivity: Consensus-based recommendations for the diagnosis and management of dentin hypersensitivity. J Can Dent Assoc 69:221–226, 2003.
11. Gaffar A: Treating hypersensitivity with fluoride varnishes. Compend Contin Educ Dent 19:1088–1097, 1998.
12. Dababneh RH, Khouri AT, AddyM: Dentine hypersensitivity – An enigma? A review of terminology, epidemiology, mechanisms, aetiology and management. Br Dent J 187:606-611, 1999.
13. Pashley DH, Tay FR, Haywood VB, Collins MC, Drisko CL: Dentin hypersensitivity: Consensus-based recommendations for the diagnosis and management of dentin hypersensitivity. Inside Dent 4 (Spec Iss):1-35, 2008.
14. Haywood VB: Dentine hypersensitivity: Bleaching and restorative considerations for successful management. Int Dent J 52 (Suppl):376-384, 2002.
15. IdeM: The differential diagnosis of sensitive teeth. Dent Update 25:462-466, 1998.
16. Närhi M, Jyväsjärvi E, Virtanen A, Huopaniemi T, Ngassapa D, Hirvonen T: Role of intradental A- and C-type nerve fibres in dental pain mechanisms. Proc Finn Dent Soc 88 (Suppl):507–516, 1992.
17. West NX: Dentine hypersensitivity. En: Dental Erosion. Lussi A, ed., Karger, Basel, pp. 173–189, 2006.
18. Brännström M: Etiology of dentin hypersensitivity. Proc Finn Dent Soc 88 (Suppl):7–13, 1992. 19. Absi EG, AddyM, Adams D: Dentin hypersensitivity: A study of the patency of dentinal tubules in sensitive and non-sensitive cervical dentine. J Clin Periodontol 14:280–284, 1987.
20. Absi EG, Addy M, Adams D: Dentine hypersensitivity: The development and evaluation of a replica technique to study sensitive and non-sensitive cervical dentine. J Clin Periodontol 16:190–195, 1989.
21. Smith RG: Gingival recession. Reappraisal of an enigmatic condition and a new index for monitoring. J Clin Periodontol 24:201–205, 1997.
22. Drisko CH: Dentine hypersensitivity—Dental hygiene and periodontal considerations. Int Dent J 52:385–393, 2002.
23. Zero DT, Lussi A: Etiology of enamel erosion—Intrinsic and extrinsic factors. En: Tooth Wear and Sensitivity. Addy M, Embery G, Edgar WM, Orchardson R, eds., Martin Dunitz, London, pp. 121–139, 2000.
24. Zero DT, Lussi A: Erosion – Chemical and biological factors of importance to the dental practitioner. Int Dent J 55 (Suppl):285–290, 2005.
25. Schweizer-Hirt CM, Schait A, Schmid R, Imfeld T, Lutz F,Mühlemann HR: Erosion and abrasion of the dental enamel. Experimental study. SSO Schweiz Monatsschr Zahnheikd 88:497–529, 1978.
26. EisenburgerM, Hughes J,West NX, Jandt KD, AddyM: Ultrasonication as a method to study enamel demineralisation during acid erosion. Caries Res 34:289–294, 2000.
27. Eisenburger M, Shellis RP, Addy M: Comparative study of wear of enamel induced by alternating and simultaneous combinations of abrasion and erosion in vitro. Caries Res 37:450–455, 2003.
28. Report of a global survey of 11000 adults about sensitive teeth. Research Quorum, Basingstoke, Hampshire, UK, 2002.
29. Murray LE, Roberts AJ: The prevalence of self-reported hypersensitive teeth. Arch Oral Biol 39 (Suppl):1295, 1994.
30. Flynn J, Galloway R, Orchardson R: The incidence of ‘hypersensitive’ teeth in the west of Scotland. J Dent 13:230–236, 1985.
31. Graf HE, Galasse R: Morbidity, prevalence and intra-oral distribution of hypersensitive teeth. J Dent Res 56 (Spec Iss):479, 1977.
32. Fischer C, Fischer RG, Wennberg A: Prevalence and distribution of cervical dentine hypersensitivity in a population in Rio de Janeiro, Brazil. J Dent 20:272–276, 1992.
33. Barthold PM: Dentinal hypersensitivity: A review. Aust Dent J 51:213–218, 2006.
34. HodoshM: A superior desensitizer—Potassium nitrate. JADA 88:831–832, 1974.
35. Markowitz K, Kim S: The role of selected cations in the desensitization of intradental nerves. Proc Finn Dent Soc 88 (Suppl):39–54, 1992.
36. Oral health care drug products for over-the-counter home use; Amendment to the tentative final monograph to include over-the-counter relief of oral discomfort drug products. Federal Register 56, 185, 48302–48346, 1991.
37. Tarbet WJ, Silverman G, Stolman JM, Fratarcangelo PA: Clinical evaluation of a new treatment for dentinal hypersensitivity. J Periodontol 51:535–540, 1980.
38. Nagata T, Ishida H, Shinohara H, Nishikawa S, Kasahara S, Wakano Y, Daigen S, Troullos ES: Clinical evaluation of a potassium nitrate dentifrice for the treatment of dentinal hypersensitivity. J Clin Periodontol 21:217–221, 1994.
39. Schiff T, Dos Santos M, Laffi S, YoshiokaM, Baines E, Brasil KD, McCool JJ, DeVizio W: Efficacy of a dentifrice containing 5% potassium nitrate and 1500 ppm sodium monofluorophosphate in a precipitated calcium carbonate base on dentinal hypersensitivity. J Clin Dent 9:22–25, 1998.
40. Silverman G: The sensitivity-reducing effect of brushing with a potassium nitrate-sodium monofluorophosphate dentifrice. Compend Contin Educ Dent 6:131–136, 1985.
41. Council on Dental Therapeutics: Evaluation of Denquel Sensitive Teeth toothpaste. JADA 105:80, 1982.
42. Silverman G, Gingold J, Clark GE: The effectiveness of potassium nitrate and sodium monofluorophosphate dentifrices in reducing dentinal hypersensitivity. J Dent Res 67:247, 1988.
43. Salvato AR, Clark GE, Gingold J, Curro FA: Clinical effectiveness of a dentifrice containing potassium chloride as a desensitizing agent. Am J Dent 5:303–306, 1992.
44. Silverman G, Gingold J, Curro FA: Desensitizing effect of a potassium chloride dentifrice. Am J Dent 7:9–12, 1994.
45. Chesters R, Kaufman HW, Wolff MS, Huntington E, Kleinberg I: Use of multiple sensitivity measurements and logit statistical analysis to assess the effectiveness of a potassium citrate-containing dentifrice in reducing dentinal hypersensitivity. J Clin Periodontol 19:256–261, 1992.
46. HuD, Zhang YP, Chaknis P, Petrone ME,Volpe AR, DeVizio W: Comparative investigation of the desensitizing efficacy of a new dentifrice containing 5.5% potassium-citrate: An eight-week clinical study. J Clin Dent 15: 6–10, 2004.
47. Schiff T, Dotson M, Cohen S, DeVizio W, McCool J, Volpe A: Efficacy of a dentifrice containing potassium nitrate, soluble pyrophosphate, PVM/MA copolymer, and sodium fluoride on dentinal hypersensitivity: A twelveweek clinical study. J Clin Dent 5 (Spec Iss):87–92, 1994.
48. Ayad F, Berta R, DeVizio W, McCool J, Petrone ME, Volpe AR: Comparative efficacy of two dentifrices containing 5% potassium nitrate on dentinal sensitivity: A twelve-week clinical study. J Clin Dent 5 (Spec Iss): 97–101, 1994.
49. Wara-aswapati N, Kringnawakul D, Jiraviboon D, Adulyanon S, Karimbux N, Pitiphat W: The effect of a new toothpaste containing potassium nitrate and triclosan on gingival health, plaque formation and dentine hypersensitivity. J Clin Periodontol 32:553–558, 2005.
50. Tarbet WJ, Silverman G, Fratarcangelo PA, Kanapka JA: Home treatment for dentinal hypersensitivity: A comparative study. JADA 105:227–230, 1982.
51. Kanapka JA: Current treatment for dentinal hypersensitivity. A new agent. Compend Contin Educ Dent (Suppl):S118–S120, 1982.
52. Silverman G, Berman E, Hanna CB, Salvato A, Fratarcangelo PA, Bartizek RD, Bollmer BW, Campbell SL, Lanzalaco AC, MacKay BJ, McClanahan SF, PerlichMA, Shaffer JB: Assessing the efficacy of three dentifrices in the treatment of dentinal hypersensitivity. JADA 127:191–201, 1996.
53. Manochehr-Pour M, Bhat M, Bissada N: Clinical evaluation of two potassium nitrate toothpastes for the treatment of dentinal hypersensitivity. Periodont Case Rep 6:25–30, 1984.
54. West NX, AddyM, Jackson RJ, Ridge DB: Dentine hypersensitivity and the placebo response. A comparison of the effect of strontium acetate, potassium nitrate and fluoride toothpastes. J Clin Periodontol 24:209–215, 1997.
55. Gillam DG, Bulman JS, Jackson RL, Newman HN: Comparison of 2 desensitizing dentifrices with a commercially available fluoride dentifrice in alleviating cervical dentine sensitivity. J Periodontol 67:737–742, 1996.
56. Poulsen S, Errboe M, Lescay Mevil Y, Glenny AM: Potassium containing toothpastes for dentine hypersensitivity. Cochrane Database Syst Rev 3: CD001476, 2006
57. Orchardson R, Gillam DG: The efficacy of potassium salts as agents for treating dentin hypersensitivity. J Orofac Pain 14:9–19, 2000.
58. Orchardson R, Gillam DG: Managing dentin hypersensitivity. JADA 137: 990–998, 2006.
59. Blong MA, Volding B, Thrash WJ, Jones DL: Effects of a gel containing 0.4 percent stannous fluoride on dentinal hypersensitivity. Dent Hyg (Chig) 59: 489–492, 1985.
60. Snyder RA, Beck FM, Horton JE: The efficacy of a 0.4% stannous fluoride gel on root surface hypersensitivity. J Dent Res 62:237, 1985.
61. Thrash WJ, Dodds MW, Jones DL: The effect of stannous fluoride on dentinal hypersensitivity. Int Dent J 44 (Suppl):107–118, 1994.
62. Schiff T, Saletta L, Baker RA, Winston JL, He T: Desensitizing effect of a stabilized stannous fluoride/sodium hexametaphosphate dentifrice. Compend Contin Educ Dent 26 (Suppl):35–40, 2005.
63. Miller S, Truong T, Heu R, Stranick M, Bouchard D, Gaffar A: Recent advances in stannous fluoride technology: Antibacterial efficacy and mechanism of action towards hypersensitivity Int Dent J 44 (Suppl):83–98, 1994.
64. Walters PA: Dentinal hypersensitivity: A review. J Contemp Dent Pract 6: 107–117, 2005.
65. Kleinberg I: SensiStat. A new saliva-based composition for simple and effective treatment of dentinal sensitivity pain. Dent Today 21:42–47, 2002.
66. Data on file, Colgate-Palmolive Company.
67. Ayad F, Ayad N, Zhang YP, DeVizio W, Cummins D, Mateo LR: Comparing the efficacy in reducing dentin hypersensitivity of a new toothpaste containing 8% arginine, calcium carbonate, and 1450 ppm fluoride to a commercial sensitive toothpaste containing 2% potassium ion: An eight-week clinical study on Canadian adults. J Clin Dent 20 (Spec Iss):10–16, 2009.
68. Docimo R, Montesani L, Maturo P, Costacurta M, Bartolino M, DeVizio W, Zhang YP, Cummins D, Dibart S, Mateo LR: Comparing the efficacy in reducing dentin hypersensitivity of a new toothpaste containing 8.0%arginine, calcium carbonate, and 1450 ppm fluoride to a commercial sensitive toothpaste containing 2% potassium ion: An eight-week clinical study in Rome, Italy. J Clin Dent 20 (Spec Iss):17–22, 2009.
69. Petrou I, Heu R, Stranick M, Lavender S, Zaidel L, Cummins D, Sullivan RJ, Hsueh C, Gimzewski JK: A breakthrough therapy for dentin hypersensitivity: How dental products containing 8% arginine and calcium carbonate work to deliver effective relief of sensitive teeth. J Clin Dent 20 (Spec Iss):23–31, 2009.



